Propiedades periódicas de los elementos químicos
Al analizar el ordenamiento de los átomos en la tabla periódica observamos que, en los grupos, las propiedades de estos son semejantes y en los períodos tienen una variación que podemos explicar. Pero es importante destacar que las propiedades de los átomos son debidas a la naturaleza de los mismos, y no su localizacion en la tabla.
¿Qué son las propiedades periódicas?
Muchas propiedades físicas y químicas de los elementos varían con regularidad periódica cuando se ordenan estos por orden creciente de su número atómico.
- La configuración electrónica
- La energía de ionización
- La afinidad electrónica
- La electronegatividad
- El volumen atómico
- El caracter metálico y no metálico
- El número de oxidación
La configuración electrónica
Los electrones están distribuidos en cada átomo en niveles o capas de energía. Los elementos de un mismo perído tiene el mismo número de niveles electrónicos (completos o no), y este número coincide con el número del período. El número máximo de electrones que caben en un nivel esta dato por la fórmula 2n2 , sindo n el número de nivel.
Cada nivel o capa de energía puede tener uno o más subniveles con distinto número de electrones.
Configuración electrónica en subniveles
Los subniveles del tipo s pueden tener uno o dos electrones, los subniveles de tipo p de uno a seis electrones y los subnivles de tipo d de uno a diez electrones, tambien puede haber subnivles de tipo f que pueden tener de uno a catorce electrones, para capas o niveles superiores a tres. En la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller.
El diagrama de Moeller es una guía utilizada en química para calcular la configuración electrónica de un átomo mediante su número atómico (Z). Es aplicable en la mayoría de los elementos, con alguna excepciones. El orden de ocupación de los subniveles del átomo por los electrones es de menos a más energía. Al escribir la configuración electrónica de un elemento se pone primero el número del nivel y después el del subnivel con el número de electrones que lo ocupan. Es decir 1s2, 2s2p6 o tambien (2,8) . Veamos ahora unas reglas que nos permitan conocer fácilmente la estructura electrónica de un elemento, sin más que saber previamente su posición en el sistema periódico:
- El número de capas electrónicas que posee un átomo coincide con el del período al que pertenece el elemento en el sistema periódico.
- Salvo el H (1s) y el He (1s2) , todos los demas elementos tienen estructura s2 en la primera capa y s2p2 en todas las restantes , excepto en la última.
- Número de electrones de la última capa:
- Para los gases nobles: s2p6 (salvo el He que es 1S2)
- Para los elementos de transición s2
- Para los demás, coincide con el número de la columna a la que pertenece el elemento en el sistema periódico.
- Cada vez que se atraviesa totalmente la serie de elementos de transición pertenecientes a un período, se coloca d10 en la capa, cuyo número coincide con el anterior al período atravesado. Es decir que si atravesamos los elementos de trensición en la capa 5, colocaremos d10 en la capa 4.
- Los elementos de transición tienen s2 en la última capa, y en la penúltima, tantos electrones d como indica el número de orden que ellos hacen dentro de la serie de transición a la que pertenece.
- Los elementos lantánidos y actínidos (denominados tierras raras) presentan la estructura S2 en la ultima capa; s2p6 d, en la penúltima, y en la antepenúltima tantos electroness f como indica el número de orden que hace el elemento dentro de su familia.
Energía de ionización
Afinidad electrónica
La afinidad electrónica (Eea) o electroafinidad se define como la energía liberada cuando un átomo gaseoso neutro en su estado fundamental captura un electrón y forma un ion mononegativo.
Electronegatividad
La electronegatividad puede definirse como la tendencia que tienen los átomos a captar electrones. La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su número atómico y la distancia promedio de los electrones de valencia con respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su teoría del enlace de valencia. La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Volumen atómico
El volumén atómico fue definido por Meyer como el espacio que ocupa el átomo de un elemento y lo calculo dividiendo la masa atómica del elemento por su densidad.
Carácter metálico
Número de oxidación
- En un mismo grupo, los elementos suelen presentar números de oxidación comunes
- El número de oxidación más alto que presenta un elemento coincide con el número del grupo al que pertenece (desde 1 hasta 7).
- Los elementos del grupo 1 (Li, Na , K, Rb, Cs, Fr) tiene número de oxidación +1
- Los elementos del grupo 2 (Be, Mg, Ca , Sr, Ba, Ra) tiene número de oxidación +2
- Los elementos del grupo 14 (C, Si , Ge, Sn, Pb, Fl) tiene número de oxidación +4
Regularidades en las propiedades
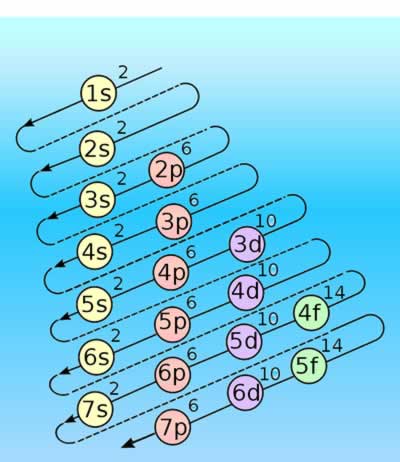 Diagrama de Moeller
Diagrama de MoellerEl diagrama de Moeller es una guía utilizada en química para calcular la configuración electrónica de un átomo mediante su número atómico (Z). Es aplicable en la mayoría de los elementos, con excepciones en los metales de transición y en elementos de número atómico elevado.
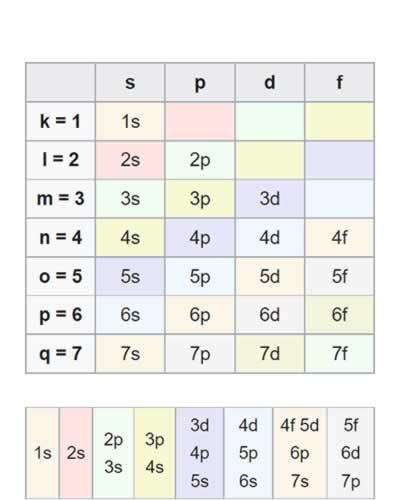 Tabla del diagrama de Moeller
Tabla del diagrama de MoellerLa configuración electrónica de los elementos se rige según el diagrama de Moeller. Para comprender el diagrama se puede utilizar la siguiente tabla, para encontrar la distribución electrónica se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
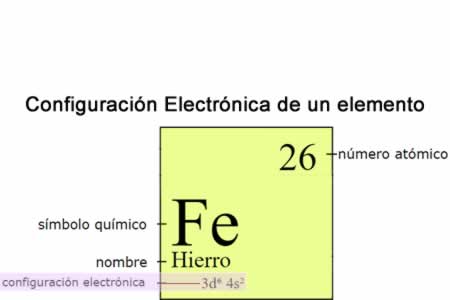 Configuración electrónica
Configuración electrónicaLa configuración electrónica indica la forma en la cual los electrones se estructuran, comunican u organizan en un átomo de acuerdo con el modelo de capas electrónicas , es importante, porque determina las propiedades totales de combinación química de los átomos, por lo tanto su posición en la tabla periódica de los elementos.
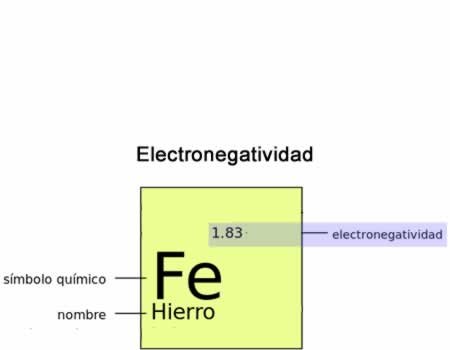 Electronegatividad
ElectronegatividadLa electronegatividad es la fuerza, el poder de un átomo de atraer a los electrones hacia sí mismo.También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares.La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su número atómico y la distancia promedio de los electrones de valencia con respecto al núcleo atómico.
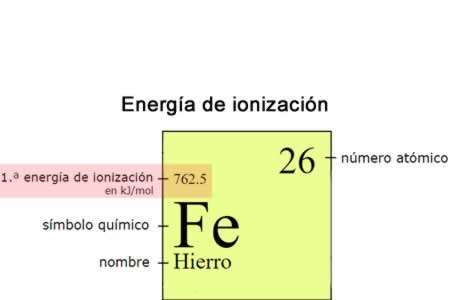 Energía de ionización
La energía de ionización (Ei) es la energía necesaria para separar un electrón en su estado fundamental de un átomo de un elemento en estado gaseoso.
Energía de ionización
La energía de ionización (Ei) es la energía necesaria para separar un electrón en su estado fundamental de un átomo de un elemento en estado gaseoso.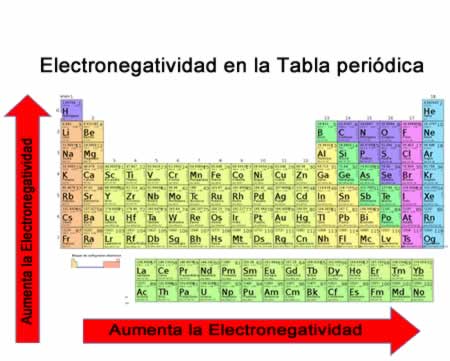 En la tabla periódica se puede observar cuándo el valor de la electronegatividad aumenta o disminuye
La electronegatividad no es una propiedad que pueda cuantificarse ni tampoco posee valores absolutos. Esto es porque la tendencia de un átomo de atraer densidad electrónica hacia él no es la misma en todos los compuestos. En otras palabras: la electronegatividad varía en función de la molécula.
En la tabla periódica se puede observar cuándo el valor de la electronegatividad aumenta o disminuye
La electronegatividad no es una propiedad que pueda cuantificarse ni tampoco posee valores absolutos. Esto es porque la tendencia de un átomo de atraer densidad electrónica hacia él no es la misma en todos los compuestos. En otras palabras: la electronegatividad varía en función de la molécula.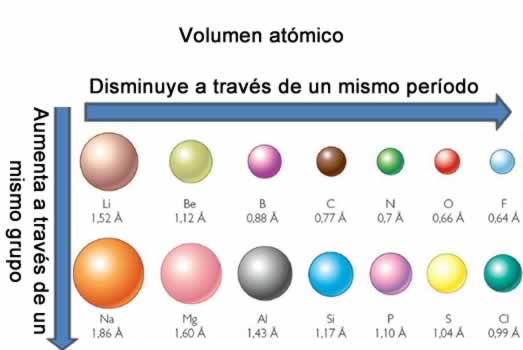 Volumen atómico
Volumen atómicoEl volumen atómico es el volumen que ocupa un mol de átomo del elemento considerado. Los grupos con mayor volumen atómico son los metales del bloque s, después los no metales, y finalmente los metales de transición. En un periodo disminuye hacia la derecha de la tabla periódica, salvo en los elementos cobre, zinc y galio donde el volumen y los volúmenes atómicos tienen una relación con la periodicidad química, los elementos con menor volumen atómico son los del grupo 5.
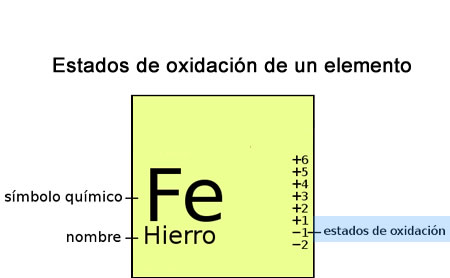 Estado de oxidación
El estado de oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química. Un átomo tiende a obedecer la regla del octeto para así tener una configuración electrónica igual a la de los gases nobles, los cuales son muy estables químicamente. Dicha regla sostiene que un átomo tiende a tener ocho electrones en su nivel de energía más externo. En el caso del hidrógeno este tiende a tener 2 electrones, lo cual le proporcionaría la misma configuración electrónica que la del helio.
Estado de oxidación
El estado de oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química. Un átomo tiende a obedecer la regla del octeto para así tener una configuración electrónica igual a la de los gases nobles, los cuales son muy estables químicamente. Dicha regla sostiene que un átomo tiende a tener ocho electrones en su nivel de energía más externo. En el caso del hidrógeno este tiende a tener 2 electrones, lo cual le proporcionaría la misma configuración electrónica que la del helio.