Composición de la materia
El mundo material nos impresiona por la cantidad y variedad de sustancia diferentes que en el podemos distinguir. Existen unas pocas sustancias simples y muchas compuestas.
Los elementos químicos
Las investigaciones de físicos y químicos acerca de la composición de la materia nos muestra que hay poco mas de un centenar de distintas sustancias simples y millones de sustancias compuestas.
Sustancias simples
Entendemos por sustancias a aquellas que estan formadas por una sola clase de partículas mas pequeña de la materia.
Una sustancia simple es aquella formada por átomos o moléculas de un solo elemento químico. Por ejemplo, el oxígeno atómico o monoxígeno (O), el dioxígeno, más conocido como oxígeno molecular (O2), y el ozono o trioxígeno (O3) son sustancias simples, porque sus moléculas están formadas solo por átomos de oxígeno. Otro ejemplo lo constituyen el diamante y el grafito, que son sustancias simples por estar formadas por átomos de una única clase, los del elemento carbono, aunque unidos entre sí de distinta forma. Del mismo modo, si observamos en un microscopio una lámina de oro se encontrará solo oro en toda la lámina.
Las sustencias simples como hidrógeno, oxígeno, carbono y otros más se pueden dividir en partes cada vez más pequeñas, hasta el momento en que no pueden hacerces más pequeñas sin perder sus propiedades características, a esta partícula la llamaremos átomo.
- Elemento: es cada uno de los tipos de sustancias simples posibles en la naturaleza.
- Atomo: es la menor porción de un elemento que conserva sus propiedades caractrísticas.
- Molécula: esta formada por la union de varios átomos y es la menor porción de sustancia que conserva sus características propias.
Los compuestos naturales se presentan como tales en la naturaleza, mientras que los compuestos artificiales has sido producidas por las personas en laboratorios, industrias. Las química estudia, tanto en unos como en otros, su composición, comportamiento, propiedades, relaciones. etc.
Sustancias compuestas
Hay otras muchas sustancias materiales, formadas por dos o más sustancias simples que son llamados sustencias compuestas. Por ejemplo, en la electrólisis del agua obtenemos dos sustancias simples oxígeno e hidrógeno, el agua es por lo tanto una sustancia compuesta. La mayor parte de la materia conocida está formada por sustancias compuestas. Los elementos de un compuesto no se pueden dividir ni separar por procesos físicos (decantación, filtración, destilación), sino solo mediante procesos químicos.
Los símbolos: notación simplificada para cada elemento
Daltón a principios del siglo XIX, propuso una serie de símbolos para representar los elementos químicos hasta entonces conocidos. Esta serie de dibujos se fue complicando a medida que se iban conociendo más elementos químicos, de manera que era más dificil recordar su símbolo que su nombre, fue el químico sueco Berzelius.
Berzelius, en 1814, presentó su primera tabla de “pesos atómicos” conteniendo 43 elementos, y en el año de 1818 la extendió a 45 elementos con un anexo de la composición porcentual y del peso-fórmula de cerca de 2 mil compuestos. Berzelius sugirió la simbología que se usa en la actualidad y se declaró contra el padrón de Dalton, de manera resumida esta consiste en lo siguiente:
- Cada elemento químico se representa con un símbolo , que suele ser la inicial de su nombre en mayúscula. Por ejemlo hidrógeno (H) , oxígeno (O).
- Para subsanar coincidencias entre elementos que empiezan por la misma letra , esta suele acompañarse con la segunda letra en minúscula . Por ejemlo el Calcio (Ca) o el Berilio (Be)
- Algunos elementos se nombran en latín o griego por lo que su símbolo proviene del nombre en esta lengua clásica, estos son en general metales conocidos desde la antiguedad como por ejemplo el hierro , ferrum en latin (Fe) o el oro aurum (Au) . Se nombran en griego sobre todo los gases nobles como el helio (He)
Las fórmulas
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura química .
 Símbolos utilizados por Daltón
Símbolos desarrollados por Daltón para algunos elementos químicos , en este sistema, los átomos eran simbolizados por círculos, grandes y pequeños, vacíos o llenos, de diferentes series de líneas, trazos o puntos
Símbolos utilizados por Daltón
Símbolos desarrollados por Daltón para algunos elementos químicos , en este sistema, los átomos eran simbolizados por círculos, grandes y pequeños, vacíos o llenos, de diferentes series de líneas, trazos o puntos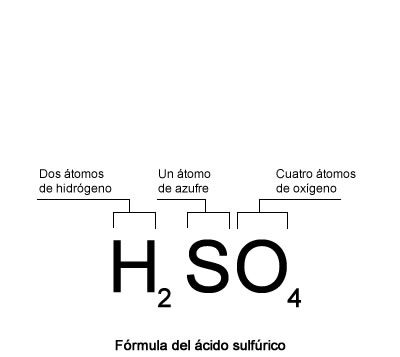 Ejemplo de una fórmula química
Una fórmula química es la representación de aquellos elementos que forman un compuesto. La fórmula refleja la proporción en que se encuentran estos elementos en el compuesto o el número de átomos que componen una molécula.
Ejemplo de una fórmula química
Una fórmula química es la representación de aquellos elementos que forman un compuesto. La fórmula refleja la proporción en que se encuentran estos elementos en el compuesto o el número de átomos que componen una molécula.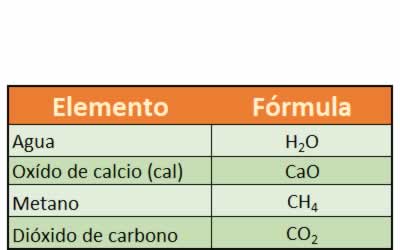 Alguna fórmulas químicas comunes en la vida cotidiana
Alguna fórmulas químicas comunes en la vida cotidiana
