Leyes de los gases
La gran ventaja de los gases con respecto a los solidos y los líqudos es que tienen un comportamiento semajante frente a las variaciones de presión y temperatura
Las primeras leyes sobre los gases se comenzaron a desarrollar a fines del siglo XVII, esto fue cuando los científicos empezaron a darse cuenta de que en las relaciones, entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases.
Un gas cuyo comportamiento sigue estas leyes con exactitud recibe el nombre de gas ideal y de la combinación de estas leyes surge la ecuación general de estado de un gas ideal, que se conoce con el nombre de ley de los gases ideales.
Ley de Boyle-Mariotte
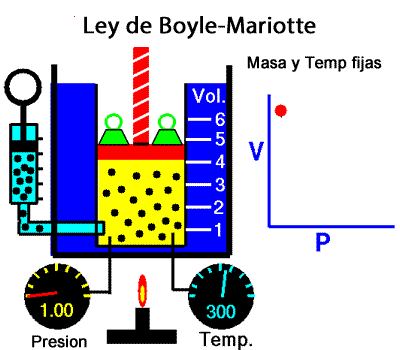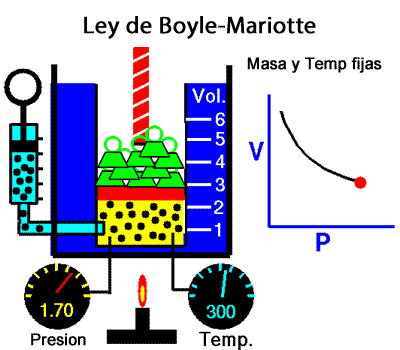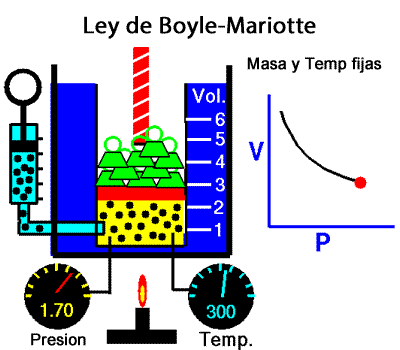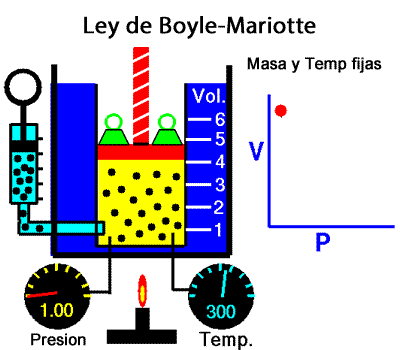
Los experimentos realizados en 1662 por el científico inglés Robert Boyle lo llevaron a establecer que el volumen de una masa determinada de aire es inversamente proporcional a la presión que se ejerce sobre ella; es decir, si se duplica la presión, el volumen se reduce a la mitad. Boyle no especificó que sus experimentos los había realizado a temperatura constante. En 1676, el francés Edme Mariotte encontró los mismos resultados y aclaró que para que la ley sea válida la temperatura debía ser constante. Estos resultados, válidos para cualquier masa de gas a temperatura constante, se conocen como ley de Boyle-Mariotte, según la cual el volumen de una determinada masa de gas, a temperatura constante, es inversamente proporcional a la presión de ese gas, su expresión matemática es:
A temperatura constante, el volumen ocupado por una determinada masa de gas es inversamente proporcional a la presión.
Presion x Volumen = constante |
Ley de Gay-Lussac
El químico frances Gay-Lussac, a comienzos del siglo XIX , estudio que encerrando gas en un recipiente en el que no se podia expandir libremente , la variación de la presión que ejercen los gases cuando aumenta la temperatura.
La ley de Gay-Lussac postula que las presiones ejercidas por un gas sobre las paredes del recipiente que lo contienen son proporcionales a sus temperaturas absolutas cuando el volumen es constante.
Estrictamente la ley de Gay-Lussac es válida para gases ideales y en los gases reales se cumple con un gran grado de exactitud sólo en condiciones de presión y temperaturas moderadas y bajas densidades del gas. A altas presiones la ley necesita corregirse con términos específicos según la naturaleza del gas.
A volumen constante, la presión ejercida por una determinada masa de gas en directamente proporcional a la temperatura.
Presion % Temperatura = constante |
Ley de Charles
La ley lleva el nombre del físico, químico e inventor francés Jacques Charles, quien formuló la ley original en su obra inédita de la década de 1780. La ley fue publicada por primera vez por filósofo natural francés Louis Joseph Gay-Lussac en 1802, pero fue descubierta por Jacques Charles ya en 1787.
La ley de Charles es también conocida como la ley de los volúmenes y es una ley experimental de los gases que describe cómo los gases tienden a expandirse cuando se calientan. Un enunciado moderno de la ley de Charles. Cuando la presión sobre una muestra de gas seco se mantiene constante, la temperatura Kelvin y el volumen estarán en proporción directa.
A volumen constante la presión ejercida por una determinada masa de gas es directamente proporcional a la temperatura.
Presion%Temperatura = Constante |
 Ley de Boyle-Mariotte
A temperatura constante, el volumen ocupado por una determinada masa de gas es inversamente proporcional a la presión.
Ley de Boyle-Mariotte
A temperatura constante, el volumen ocupado por una determinada masa de gas es inversamente proporcional a la presión.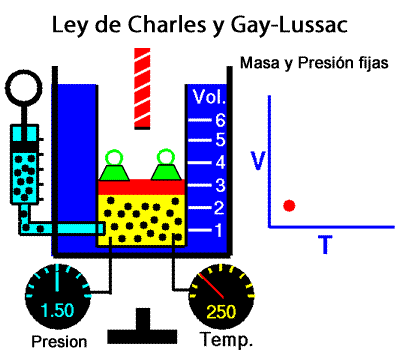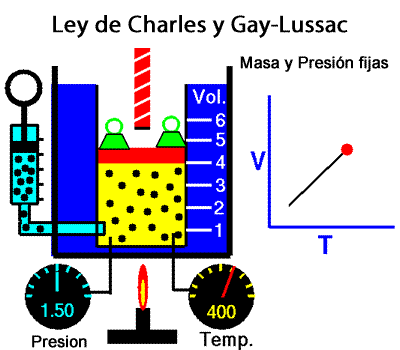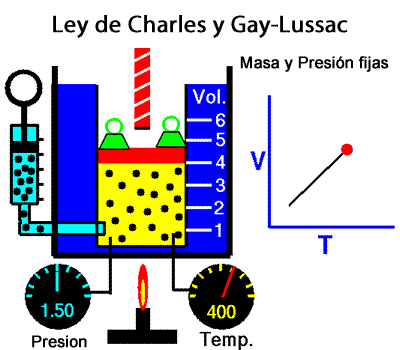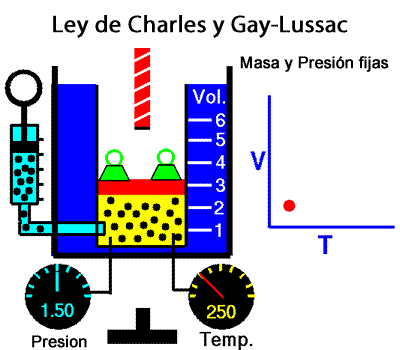 La ley de Charles y Gay-Lussac La ley de Charles y Gay-Lussac, o ley de los volúmenes, se dice que, para un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura absoluta (en kelvin).
La ley de Charles y Gay-Lussac La ley de Charles y Gay-Lussac, o ley de los volúmenes, se dice que, para un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura absoluta (en kelvin).