Tipos de reacciones químicas
Una reacción química, es todo proceso termodinámico en el cual dos o más o sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Esto se da a cada momento como la fotosíntesis en las plantas, en nuestro cuerpo la respiración o digestión de alimentos o en laborarorios industriales
Clasificación de las reacciones químicas
Las reacciones químicas se clasifican por la energía que requieren o liberan, o bien por el proceso a que se someten los reactivos. Si una reacción química libera energía, se llama reacción exotérmica. El ejemplo más común es la combustión, en la cual la energía se manifiesta en forma de calor y luz. Si, por el contrario, la reacción química requiere energía del medio para efectuarse, recibe el nombre de reacción endotérmica. La fotosíntesis es un proceso de esta clase, porque requiere de la luz solar para realizarse.
Varios tipos de reacciones químicas son considerados muy importantes ellas son síntesis, descomposición, sustitución y de doble desplazamiento.
- Reacción de síntesis o combinación. En ésta, dos o más sustancias se unen para formar otra; por ejemplo, cuando se combinan azufre y hierro, se sintetiza sulfuro de hierro. El polvo amarillo de azufre y la limadura de hierro reaccionan y se convierten en un nuevo producto que posee propiedades totalmente distintas de las que caracterizan a esos elementos. Las reacciones de este tipo tienen gran utilidad industrial; gracias a ellas, cada día se cuenta con nuevos productos, como medicamentos, plástico, materiales cerámicos, etc.
- Reacción de descomposición. En este caso, una sustancia se divide en otras dos, que forzosamente son más sencillas, es decir, están compuestas por menos átomos. Muchas reacciones de descomposición requieren energía eléctrica para llevarse a cabo; por ejemplo, mediante la corriente eléctrica se pueden separar el oxígeno y el hidrógeno que forman el agua. El proceso que consiste en separar sustancias químicamente por medio de la electricidad se conoce como electrólisis.
- Reacción de sustitución Esta reacción es también denominada reacción de desplazamiento único y es aquella reacción química en la que un grupo funcional o átomo en un compuesto químico es sustituido por otro átomo o grupo funcional. Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en disolución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
- Reacciones de doble desplazamiento En una reacción de doble desplazamiento, dos compuestos intercambian parejas entre sí, para producir compuestos distintos. Esta reacción puede considerarse como un intercambio de grupos positivos y negativos, en la que A se combina con D y C se combina con B. Al escribir las fórmulas de los productos debemos tener en cuenta las cargas de los que se combinan. En muchas de estas reacciones se forman sustancias insolubles. Por tanto, para producir los productos que se forman aquí, hay que familiarizarse con algunas reglas de solubilidad muy comunes.
Reacción de combustión
El principal protagonista de la combustión es el óxigeno, la vida no sería posible sin él, y la combustión, tampoco. Pero para que se produzca una reacción de combustión hace falta también un combustible.
- El alcohol, es butano o la madera son combustibles
- Las piedras o el casco de un bombero, sin embargo, son incombustibles
La combustibilidad es una propiedad característica de la materia, pues permita diferenciar las sustancias que arden de las que no arden. La combustión esun tipo de reacción química en la que los reactivos son el combustible y el oxígeno del aire, y los productos suelen ser (aunque no siempre) dióxido de carbono y vapor de agua, fijemonos los siguientes ejemplos:
- Butano+Oxígeno ⇒ dióxido de carbono+agua
- Alcohol+Oxígeno ⇒ dióxido de carbono+agua
- Carbono+Oxígeno ⇒ dióxido de carbono
Las reacciones de combustión son exotérmicas y desprenden energía, esta es una de las aplicaciones más importantes se utilizan como fuente de energía.
Monóxido de carbono
En las combustiones incompletas en motores de coches mal regulados, ademas de vapor de agua y dióxido de carbono se origina monóxido de carbono. Al ser una molécula que al combinarse con la hemoglobina impide el transporte de oxígeno a las células y que conduce a la muerte por asfixia en pocos minutos sin darnos cuenta que es denominada la muerte dulce ya que no presenta ni dolor ni olor.
Acidos y Bases
- Son altamente solubles en agua.
- Reaccionan con algunos metales.
- Funcionan como conductores de corriente eléctrica.
- Poseen sabor agrio (limón, por ejemplo).
- Cambian el color del papel tornasol del azul al rojo.
- Pueden destruir tejidos orgánicos.
- Reaccionan con bases, produciendo agua y sal.
- Las reacciones ácido-base son exotérmicas (liberan calor).
- Ácido ascórbico (vitamina C).
- Ácido cítrico, presente algunas frutas.
- Ácido acético (vinagre y vino).
- Ácido láctico, producido durante el ejercicio anaeróbico.
- Ácido acetilsalicílico (aspirina).
- Ácido clorhídrico (jugo gástrico).
- Ácido sulfúrico.
- No reaccionan con los metales.
- En disolución, conducen corriente eléctrica.
- Poseen sabor amargo (jabonoso, como el cloro/lejía).
- Cambian el color del papel tornasol del rojo al azul.
- En disolución, son deslizantes al tacto.
- Reaccionan con los ácidos, produciendo agua y sal.
- Las reacciones ácido-base son exotérmicas (liberan calor).
- Su pH es superior a 7.
- Hidróxido de magnesio (leche de magnesia).
- Hipoclorito de sodio (lejía, cloro).
- Bicarbonato de sodio (polvo de hornear).
- Tetraborato de sodio (bórax).
- Amoníaco.
- Hidróxido de sodio (soda cáustica).
Escala de pH
El pH es el potencial de hidrógeno de una disolución, ideado por el científico danés Søren Peder Lauritz Sørensen en 1909 e indica la concentración de iones de hidrógeno en una sustancia. Para representar esta concentración se utiliza una escala que señala el nivel de alcalinidad o acidez de una disolución.
Esta escala está cuantificada del 0 al 14. Las sustancias que tienen un nivel menor a 7 son consideradas ácidas, mientras que las sustancias que tienen un nivel mayor a 7 son consideradas como bases (alcalinas).
Cada movimiento de un punto a otro en la escala es logarítmico, lo que significa que un paso aumenta o disminuye la acidez/basicidad 10 veces respecto del paso inmediatamente inferior o superior. Es decir, si la acidez del vinagre es de un pH de 3, la acidez del jugo de limón es 10 veces superior, con un pH de 2.
El agua posee un pH que va desde el 6,5 al 8,5, en donde el pH del agua pura es 7 (que se considera neutro). Cuando el agua tiene un pH inferior a 6,5, esta puede tener metales tóxicos en su composición, siendo corrosiva y ácida. Cuando su pH es superior a 8,5, se le denomina agua dura, más básica o alcalina, con mayor presencia de magnesio y carbonatos.
Reacción de neutralización
Una reacción de neutralización es aquélla en la cual reacciona un ácido (o un óxido ácido) con una base (u óxido básico). En la reacción se forma una sal y en la mayoría de casos se forma agua. El único caso en el cual no se forma agua es en la combinación de un óxido de un no metal con un óxido de un metal.
ácido+base ⇒ Sal + agua
Importancia de los ácidos y las bases
Los ácidos y las bases son sumamente importantes en numerosos y diversos procesos químicos que ocurren a nuestro alrededor, desde procesos biológicos hasta industriales, existen reacciones en el laboratorio y otras en nuestro ambiente, incluso algunas que se llevan a cabo en nuestro organismo.
- Son sumamente importantes las materias primas industriales que se utilizan en la fabricación de fertilizantes, metales, plásticos y alimentos. Muchos ácidos y bases tienen variadas aplicaciones prácticas en el hogar, se usan para elaborar ácido clorhídrico, ácido nítrico, sulfatos y detergentes.
- El ambiente altamente ácido también ayuda a controlar los microorganismos potencialmente dañinos y evitar que lleguen al intestino donde pueden causar serias enfermedades. La lluvia ácida cambia la composición del suelo y desplaza los metales pesados hacia las aguas subterráneas, aumentando su toxicidad e imposibilitando su consumo. Además, los ácidos disminuyen el PH de los mantos acuíferos dulces lo que afecta al desarrollo de la fauna acuática de lagos, ríos y océanos.
- En los seres vivos nuestro estómago, por ejemplo, segrega jugos gástricos con sustancias que resultan fundamentales en el proceso de la digestión.
- Frutas y alimentos de uso común contienen ácidos en su composición. Por ejemplo, las naranjas, limones, toronjas y en general las conocidas como frutas cítricas contienen el ácido cítrico, de ahí su nombre. Los ácidos y las bases tienen un papel fundamental en los sistemas biológicos, están presentes en algunos fenómenos de contaminación ambiental y forman parte de numerosos productos medicinales, domésticos, industriales, entre otros.
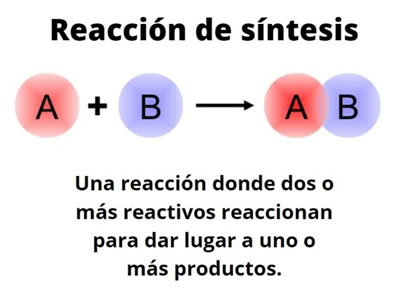 Reaccion de síntesis
Reaccion de síntesis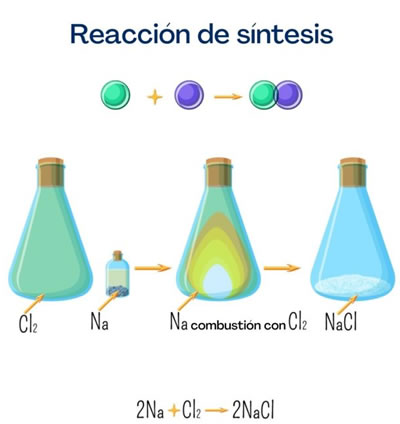 Ejemplo de reaccion de síntesis - Sal de mesa (cloruro de sodio)
Ejemplo de reaccion de síntesis - Sal de mesa (cloruro de sodio)Esta sal es una de las más conocidas por todos por su gran uso doméstico. Se obtiene a partir de sodio y cloro, y a pesar de que puede ser obtenida por la reacción siguiente es muy fácil encontrarla de forma natural.
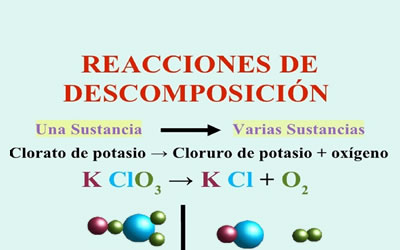 Reacciones de descomposición
Reacciones de descomposición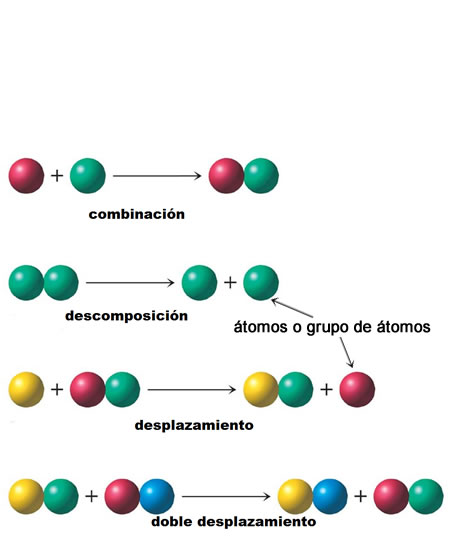 Clasificación de las reacciones químicas
Clasificación de las reacciones químicasVarios tipos de reacciones químicas son considerados muy importantes ellas son síntesis, descomposición, sustitución y de doble desplazamiento.
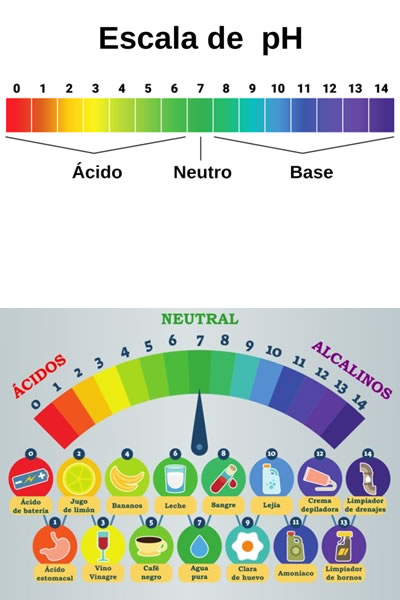 Tablas del PH y Diagrama de la escala del pH
Tablas del PH y Diagrama de la escala del pH El pH es una medida de acidez o alcalinidad de una disolución acuosa. El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones. Diagrama de la escala del pH con la correspondencia valores ácidos o alcalinos para las sustancias comunes, comida, sustancias químicas de hogar
