El mol y la Cantidad de sustancia
En una reacción química es muy importante calcular las masas de los átomos y moléculas que intervien en la reacción
Masa molecular
Como ya vimos expresamos la masa relativa de los átomos con la unidad de la masa atómico (u) .La masa molecular (M) es la suma de las masas atómicas de los atómos que integran la molécula, a continuación, calculamos las masas atómicas del H20 y CO2
- H2O . La masa atómica relativa del hidrógeno es 1 y la del oxígeno es 16 , la masa molecular del agua es 16+ (2x1) = 18
- CO2 . La masa atómica relativa del carbono es 12 y la del oxígeno es 16; la masa molecular del dióxido de carbono será 12+(2x16) = 44
El mol
Dado el tamaño extremadamente pequeño de las unidades fundamentales, y su número inmensamente grande, es imposible contar individualmente las partículas de una muestra. Esto llevó a desarrollar métodos para determinar estas cantidades de manera rápida y sencilla. Para relacionar la masa de los átomos y las moléculas con una cantidad fácil de medir en el laboratorio, los químicos han definido la magnitud de cantidad de materia y su unidad es el mol según el SI un mol es:
El mol es la unidad para medir cantidad de sustancia; la cual contiene tantas partículas elementales como átomos de carbono hay en 0,012 kg de carbono-12. La entidad debe especificarse y puede ser un átomo, una molécula, un ion, un electrón, etc. A partir del 16 de noviembre de 2018, se cambió la definición de mol y su patrón, pasando de ser la cantidad de átomos de carbono presentes en 0,012 kg de carbono-12 a la cantidad de átomos presentes en una esfera perfecta de silicio, cuya masa es de 0,028085 kg.
Tambien se lo puede decir que
Un mol de cualquier sustancia equivale a la masa molecular expresión en gramos.
Calculamos un mol de H2O y un mol de CO2
- La masa molecular del agua es 18, un molde agua son 18g de agua
- La masa molecular de CO2 es 44, un mol de CO2son 44g de CO2
Concentración molar (M)
Es otra manera de expresar la concentración de las disoluciones ,en lugar de expresar los gramos de soluto por cada litro de disolución, podemos poner los moles de soluto por cada litro de disolución.
Molaridad = Cantidad de sustancia (mol)%Volumen de disolucion (L)
Ejemplo si tenemos 50g de NaCl en 2 litros de disolucion su concentración será
50g%2L = 25 g/L
Cálculo de cantidad de sustancia
Podemos calcular la cantidad de sustancia en moles que hay para una cierta masa de cualquier sustancia de la siguiente forma
n(mol)= m(g)%M(g/mol)
Ejemplo Hallar la cantidad de sustancia que hay en 36g de agua
n(mol) = 36g% 18g/m) = 2 mol de H2O
Número de Avogadro
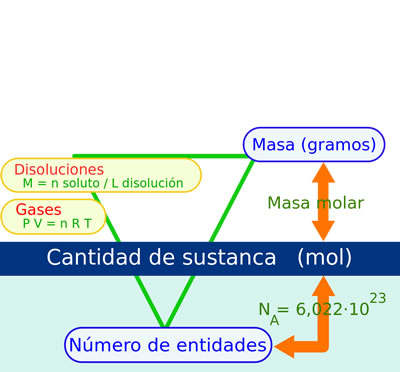 Diagrama que muestra la relación entre el mol, la masa molar, la masa en gramos, el número de partículas, la molaridad de una disolución, la ecuación de estado de la ley de los gases ideales y el número de Avogadro.
Diagrama que muestra la relación entre el mol, la masa molar, la masa en gramos, el número de partículas, la molaridad de una disolución, la ecuación de estado de la ley de los gases ideales y el número de Avogadro.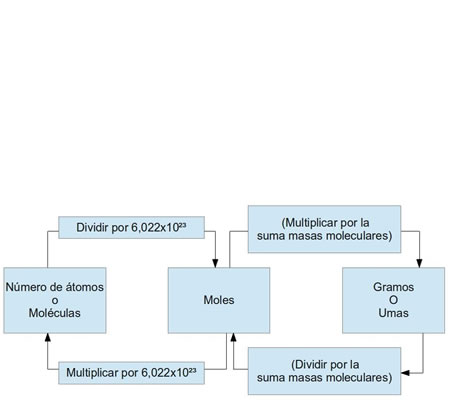 Ejemplo gráfico de la conversión de moles
Ejemplo gráfico de la conversión de moles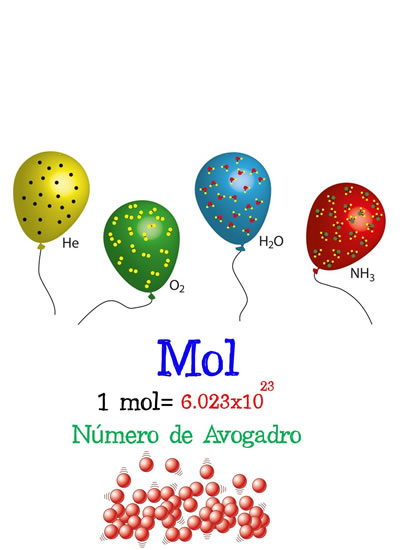 Número de Avogadro
Número de AvogadroEl número de partículas constituyentes de una sustancia (normalmente átomos o moléculas) que se pueden encontrar en la cantidad de un mol de la sustancia. Es un factor de proporción que pone en relación la masa molar (magnitud física que define la masa de una sustancia por unidad de cantidad de sustancia y se expresa en kg/mol) de una sustancia y la masa presente en una muestra.
