Energía en las reacciones químicas
Todas las reacciones químicas llevan asociado un cambio en la energía del sistema reactivo y esto implica un intercambio energético con el medio.
Se llama energía de una reacción química a la energía absorbida o desprendida en la misma por el sistema reactivo. Todas las reacciones químicas siempre involucran energía, la energía es una propiedad de la materia y está definida como la habilidad para trabajar, por ejemplo, cuando el metano se quema, por ejemplo, libera energía en forma de calor y luz. Otras reacciones químicas absorben energía en vez de liberarla.
En cualquier reacción química, la energía es absorbida o liberada (generalmente en forma de calor o luz). Esto se debe a que, al romper y formar enlaces, se absorbe y la energía se libera respectivamente.
- Calor de Reacción: Se llama calor de reacción a la energía total absorbida o transferida en una reacción química.
- Calor de Formación: El calor de formación es la energía total absorbida o transferida para formar un lunar de sustancia a partir de los elementos que lo forman. Es común ver este concepto reemplazado por otra entalpía de formación llamada y que se define como la variación de la entalpía que acompaña la formación de una molécula de sustancia a partir de los elementos que la componen.
- Calor de Combustión: El calor de combustión es la energía que se produce cuando se quema una sustancia.
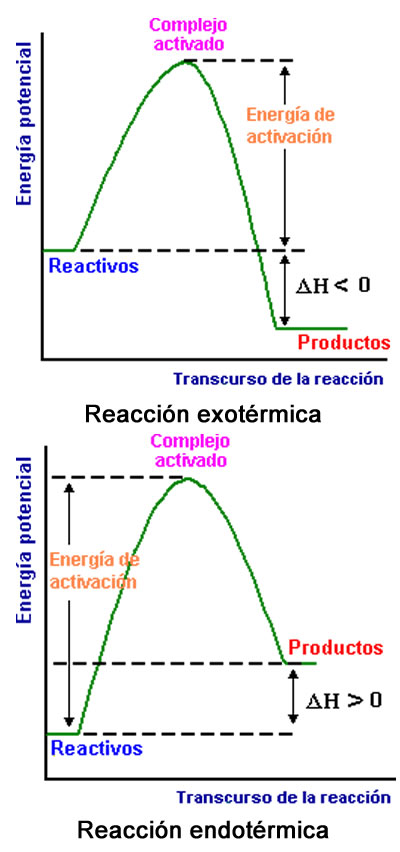
Como criterio arbitrario, se entiende por signo negativo una reacción exotérmica, que indica que el sistema pierde o libera energía, y signo positivo cuando la reacción es endotérmica, que indica que el sistema absorbe o gana energía.
Tipos de reacciones químicas
C(s)+O(g) CO2 - 395 kj/mol
Es decir que la combustion de 1 mol de carbón en estado sólido desprende 395 Kj. El sistema ha perdido 395 Kj de energía química.
- Reacciones Exotérmicas Una reacción química que libera energía (como calor) se llama reacción exotérmica . Este tipo de reacción puede representarse por una ecuación química general:
Reactantes → Productos + Calor
- Reacciones Endotérmicas Una reacción que absorbe energía se llama reacción endotérmica . Este tipo de reacción puede representarse por una ecuación química general también:
Química y deporte
Las lesiones leves que sufren los deportistas (golpes ,contracturas, esguinces) pueden aliviarse con ayuda de unas “bolsas frias” al aplicarse esta bolsas el hidrato de amonio que contienen se disuelve en el agua produciendo un enfriamientos brusco de la disolucion al ser un proceso endotérmico. En otro caso se necesita calor para aliviar los dolores musculares. Las llamadas “bolas de calor” contienen cloruro de calcio anhidro, que al disolverse en agua desprende calor.
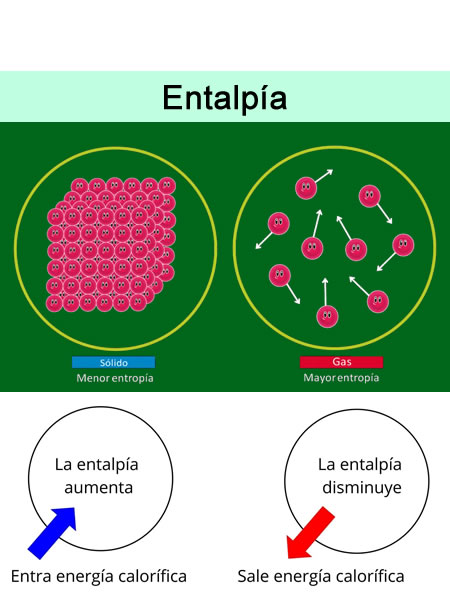
¿Qué es la entalpía?
La entalpía es una función de estado que caracteriza a un sistema como por ejemplo un compuesto químico, un gas a presión dentro de un pistón, o incluso un planeta orbitando alrededor de una estrella. Esta propiedad se representa con el símbolo H (que proviene de la palabra calor en inglés, heat) y, desde el punto de vista termodinámico, se define como la suma entre la energía interna de un sistema (U) y el producto de su presión y su volumen (producto PV). Es decir:
A excepción de sistemas muy sencillo como por ejemplo los gases ideales, la entalpía absoluta (H) no se puede medir experimentalmente ni calcular de manera sencilla. Esto se debe a que, para sistemas relativamente complejos, la determinación de la energía interna (U) resulta inmensamente compleja de determinar, ya que se deben considerar demasiadas variables que provienen de las interacciones entre las partículas que forman el sistema.
Sin embargo, como se verá en la siguiente sección, sí se puede medir experimentalmente la variación de entalpía durante distintos procesos, lo cual permite establecer valores relativos de entalpía, en los que las entalpías de formación juegan un papel esencial.
Calor de formación y calor de combustión
Se definen dos tipos de energías o calores especielmente calor de formación y calor de combustión
Calor de formación
El calor de formación, también llamado entalpía de formación o entalpía de formación estándar, es la cantidad de calor asociado al proceso de formación de 1 mol de una sustancia química a partir de sus elementos constituyentes cuando estos se encuentran en su estado estándar, es decir, en su forma natural más estable a 25°C. En este sentido, el calor de formación representa la diferencia de entalpía entre los productos y reactivos de una reacción química llevada a cabo a 25°C en la cual el único producto es 1 mol de la sustancia de interés, mientras que el o los reactivos son los elementos que conforman a dicha sustancia en su estado natural más estable a dicha temperatura.
La entalpía de formación se representa con el símbolo ΔfH°X, donde la f indica que se trata de una entalpía de formación de la sustancia X (X corresponde a la fórmula química o el nombre de la sustancia que se forma) y el símbolo ° se utiliza para representar las condiciones estándar de reacción, en este caso T = 25 °C o 298,15 K.
Por ejemplo, el calor de formación del agua se representa como ΔfH°H2O y corresponde a la diferencia de entalpía de la siguiente reacción llevada a cabo a 25 °C:
Reacciones de formación
La anterior es un ejemplo de una reacción de formación (la reacción de formación del agua). Los detalles importantes a tomar en cuenta para reconocer una reacción de formación son:
- Solo debe haber un producto (en este caso H2O).
- El coeficiente estequiométrico del producto debe ser 1.
- Los reactivos deben ser todos sustancias elementales (en este caso hidrógeno y oxígeno), no compuestos.
- El alótropo de cada reactivo presente debe corresponder al alótropo más estable en condiciones estándar (en el caso del elemento hidrógeno, es el hidrógeno molecular gaseoso, y en el caso del oxígeno, es el oxígeno molecular gaseoso).
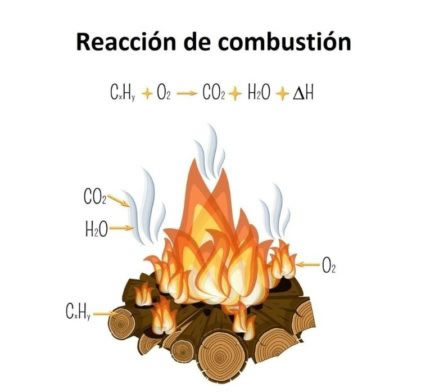
Calor de combustión
El calor de combustión es la energía liberada cuando una determinada cantidad de material, por lo general un mol, reacciona exotérmicamente con el oxígeno del aire. Se trata de una propiedad termoquímica imprescindible en la caracterización de los combustibles, alcoholes y, especialmente, hidrocarburos, tales como el butano y metano.
Cuando una sustancia se quema libera luz y calor, energía que puede aprovecharse para realizar trabajo sobre otros cuerpos. Por ejemplo, el calor generado es capaz de calentar grandes volúmenes de agua, cuyo vapor presiona los alrededores, accionando unos generadores eléctricos; o simplemente, calentando todavía más los alimentos cocinados al vapor. El calor generado por la combustión del gas de la cocina se utiliza para calentar los calderos y alimentos
El calor de combustión varía entre todas las sustancias, aun cuando su naturaleza química sea en esencia la misma. Esta variación corresponde a las estabilidades relativas, es decir: mientras más inestable sea un compuesto, mayor será la energía liberada, representada como -ΔH. El símbolo negativo significa que el calor fluye hacia afuera.
Diferentes valores de -ΔH se utilizan para comparar las estabilidades relativas entre distintos alcanos y sus isómeros. Asimismo, permite traslucir cuán estable es un compuesto oxigenado, como una cetona, frente a otro, un aldehído o ácido carboxílico.
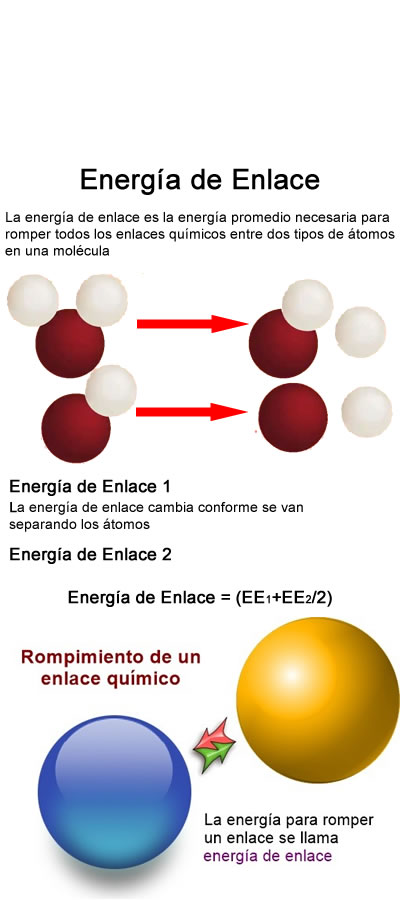
Energía de enlace
La energía de enlace (EE) es la energía total promedio que se desprendería por la formación de un mol de enlaces químicos, a partir de sus fragmentos constituyentes (todos en estado gaseoso). Alternativamente, podría decirse también que es la energía total promedio que se necesita para romper un mol de enlaces dado (en estado gaseoso).
Los enlaces más fuertes, o sea los más estables, tienen energías de enlace grandes. Los enlaces químicos principales son: enlaces covalentes, metálicos e iónicos. Aunque típicamente se le llama enlace de hidrógeno al puente de hidrógeno, este no es un enlace real sino una atracción intermolecular de más baja energía que un enlace químico.
Las atracciones intermoleculares (fuerzas de Van der Waals), comprenden las ion-dipolo, las dipolo-dipolo, y las fuerzas de dispersión de London que son atracciones típicamente más débiles que las atracciones en un enlace químico.
El puente de hidrógeno es un caso especial de la fuerza intermolecular dipolo-dipolo, que resulta ser de mayor energía relativa debido a que el hidrógeno tiene tan sólo un electrón que apantalla su núcleo positivo. Esta situación hace que la atracción entre ese hidrógeno, enlazado a un átomo electronegativo, y un átomo con carga parcial negativa sea relativamente grande.
 Ejemplos de entalpías
La entalpía es la cantidad de energía que se pone en juego en procesos a presión constante. La entalpía de combustión es la energía liberada o absorbida al quemar 1 mol de sustancia.
Ejemplos de entalpías
La entalpía es la cantidad de energía que se pone en juego en procesos a presión constante. La entalpía de combustión es la energía liberada o absorbida al quemar 1 mol de sustancia.